Vorlesung Chemie der Metalle
9. Übergangsmetalle II
IV. Nebengruppe/4. Gruppe/Titan-Gruppe
| alte Nomenklatur: (Link) |
III. NG |
IV. NG |
V. NG |
VI. NG |
VII. NG |
VIII. NG |
I. NG |
II. NG |
| neue Nomenklatur: |
3. Gr. |
4. Gr. |
5. Gr. |
6. Gr. |
7. Gr. |
8. Gr. |
9. Gr. |
10. Gr. |
11. Gr. |
12. Gr. |
| 3d |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
| 4d |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
| 5d |
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Unterkapitel:
Allgemeines, Oxidationsstufen
Zur IV. Nebengruppe, 4. Gruppe oder Titan-Gruppe gehören die Elemente
Titan (Ti), Zirkonium (Zr) und Hafnium (Hf).
Ihre allgemeine Elektronen-Konfiguration ist d2s2, woraus
sich die bevorzugte und gleichzeitig maximale Oxidationsstufe zu +4 ergibt.
Innerhalb der Gruppe beobachtet man die für die Nebengruppen typische Variation
der Oxidationsstufe, die höheren Oxidationsstufen (hier +4)
werden mit wachsender Ordnungszahl beständiger.
Diese Tendenz ist damit genau umgekehrt wie bei den Hauptgruppen.
Konkret bedeutet dies für die Elemente der 4./IV. Gruppe:
- Titan bevorzugt zwar die Oxidationsstufe +4, kommt aber auch dreiwertig
vor. Im Festkörper oder mit π-Akzeptor-Liganden ist auch die Oxidationsstufe +2 stabil.
- Bei Zirkonium kommt fast ausschließlich die Oxidationsstufe +4 vor, +2
ist sehr selten.
- Hafnium ist ausschließlich vierwertig.
Da sich damit die Chemie von Titan etwas von der der schwereren Homologe
unterscheidet, wird Titan separat, Zirkonium und Hafnium gemeinsam besprochen.
Titan
Allgemeines, Oxidationsstufen
Titan kann - neben der wichtigsten Oxidationsstufe +IV -
auch drei- und zweiwertig vorliegen. Die Oxidationsstufe +II tritt dabei vor allem im Festkörper,
z.B. in den salzartigen Halogeniden TiX2 und in TiO auf.
Titan(IV), d.h. Titan in seiner stabilsten Oxidationsstufe, weist
Ähnlichkeiten mit Silicium, Germanium oder Zinn, jeweils bei gleicher Oxidationszahl von +IV, auf.
Es liegt in i.A. oktaedrisch (Koordinationszahl 6), gelegentlich auch
tetraedrisch (CN=4) koordiniert vor. Bei Bindungspartnern mit großer
Elektronegativität haben Ti(IV)-Verbindungen auch kovalenten Bindungscharakter,
vgl. z.B. TiCl4.
Neben +IV, +III und +II gibt es auch einige wenige Beispiele für
Ti in sehr niedrigen Oxidationsstufen.
Z.B. kennt man die Trisbipyridin-Komplexe des Typs [Ti(bipy)3]-1/0, in denen
Titan 0 bzw. -1 vorliegt, sowie das Carbonylat [Ti(CO)6]2- mit Ti mit der Oxidationsstufe -2.
D.h. diese oktaedrischen Komplexe mit Titan in niedriger Oxidationsstufe
werden bevorzugt mit π-Akzeptor-Liganden ausgebildet.
Ti(IV)-Verbindungen (d0-Ionen) sind farblos, Ti(III)- und Ti(II)-Verbindungen gefärbt.
Element: Vorkommen, Eigenschaften, Gewinnung, Verwendung
Vorkommen: Titan kommt kommt in der Natur nur in Verbindungen vor.
Es ist zwar ein relativ häufiges Element, kommt jedoch stark verteilt vor.
Die drei wichtigsten Titanerze, die meist rötlich bis schwarz sind,
sind ...
 |
 |
| Rutil-Kristall |
Brookit |
 |
| alle drei Formen von TiO2 |
| Abb. 9.4.1. Modifikationen von TiO2 als Minerale |
Darstellung:
Titan kann aufgrund der Bildung des sehr stabilen Carbids TiC nicht durch
Reduktion mit Kohlenstoff erhalten werden.
Die Reduktion des Dioxids (z.B. mit Wasserstoff) führt i.A. zu verschiedenen reduzierte Oxidotitanaten (s.u.).
Daher erfolgt die Darstellung elementaren Titans immer über die Halogenide wie z.B. TiCl4.
Bei der technischen Herstellung sind folgende Teischritte erforderlich:
- Umsetzung von Titandioxid mit Chlor und Kohlenstoff (sog. Carbochlorierung) gemäß
TiO2 + 2 Cl2 + 2 C ⟶ TiCl4 + 2 CO
bei 800 bis 1200 oC.
- Reinigung des Titantetrachlorids durch Destillation.
- Reduktion mit Magnesium bei 850 oC nach dem Kroll-Verfahren:
TiCl4 + 2 Mg ⟶ Ti + 2 MgCl2
Das bei dieser Reduktion gebildete MgCl2 ist flüssig und
kann daher abgestochen werden.
- Alternativ kann die Reduktion auch mit CaH2 oder Natrium (Hunter-Verfahren)
durchgeführt werden:
TiCl4 + 4 Na ⟶ Ti + 4 NaCl
Zur Gewinnung sehr reinen Titans wird nach dem van Arkel-Verfahren
über einen chemischen Transport des Tetraiodids von 600 nach 1200 oC erhalten:
TiI4 ⇌ Ti + 2 I2
Praktisch wird hierzu ein Gemisch aus Titan und Iod in einer Röhre erhitzen und
das gereinigte Titan schlägt sich an einem heissen W-Draht nieder.
 |
| 9.4.2. Titan-Blech |
Eigenschaften, Strukturen:
Titan (s. Abb. 9.4.2.) hat mit 1677oC einen sehr hohen Schmelzpunkt.
Es ist silberweiss und ein guter elektrischer Leiter
mit einer spezifischen Leitfähigkeit von 104 Ω-1m-1.
Es kristallisiert in der hexagonal dichten Kugelpackung, oberhalb 882oC
geht es in eine kubisch innenzentriert Packung über.
Titan ist mit einem Normalpotential von E0(Ti/Ti2+) von -1.63 V
recht elektropositiv und unedel.
Eine Schutzschicht, die im Fall von Titan aus dem Oxid und/oder Nitrid, bei Zirkonium nur aus
dem Oxid ZrO2 besteht, schützt es vor dem weiteren Angriff von Luftsauerstoff.
Bei 25 atm O2 verbrennt Titan, weil es schmilzt und damit Diffusion durch die
Oxidschicht möglich ist.
Metallisches Titan hat eine Dichte von nur 4.5 g/cm3 und ist damit ein
leichter, sehr korrosionsbeständiger metallischer Werkstoff.
Es wird als solches
- in der Luft- und Raumfahrtindustrie
- im chemischen Apparatebau
- als Stahlzusatz (erhöht die Stoß- und Schlagfestigkeit)
- in der Medizintechnik
- für Schmuck usw.
verwendet.
Zirkonium hat dagegen eine Dichte von 6.5 g/cm3 und wird als Metall in der Kerntechnik
verwendet.
Titan in wässriger Lösung (vgl. Analytik)
Je nach Oxidationsstufe liegt Titan in wässriger Lösung in Form unterschiedlicher
Spezies vor:
- Ti+IV existiert nicht (auch nicht bei sehr kleinem pH)
als Hexaquakomplex [Ti(H2O)6]4+,
sondern nur in Form von Ionen mit niedrigerer Ladung wie z.B. [Ti(OH)2(H2O)4]2+ vor.
(Diese Spezies wird - nach formaler Wasserabspaltung - auch als 'Titanyl-Kation' TiO2+
bezeichnet.)
Eine einfache Laborchemikalie ist das 'Titanyl-Sulfat' TiOSO4*H2O,
ein Salz in dem oktaedrisch von Oxid/Wassermolekülen koordinierte Ti(IV)-Ionen
vorliegen. Die Oktaeder sind über benachbarte Oxidionen (dunkelrot in Abb. 9.4.3.) zu -Ti-O-Ti-O-Ketten
verknüpft, drei Ecken gehören zu Sulfat-Ionen und eine
Ecke ist ein Wassermolekül. Beim Auflösen
dieses Salzes entsteht wieder der o.g. Komplex
[Ti(OH)2(H2O)4]2+, die
beiden Protonen/Ti verteilen sich also auf zwei Liganden und die übrigen
Koordinationsstellen werden dann von Wassermolekülen eingenommen.
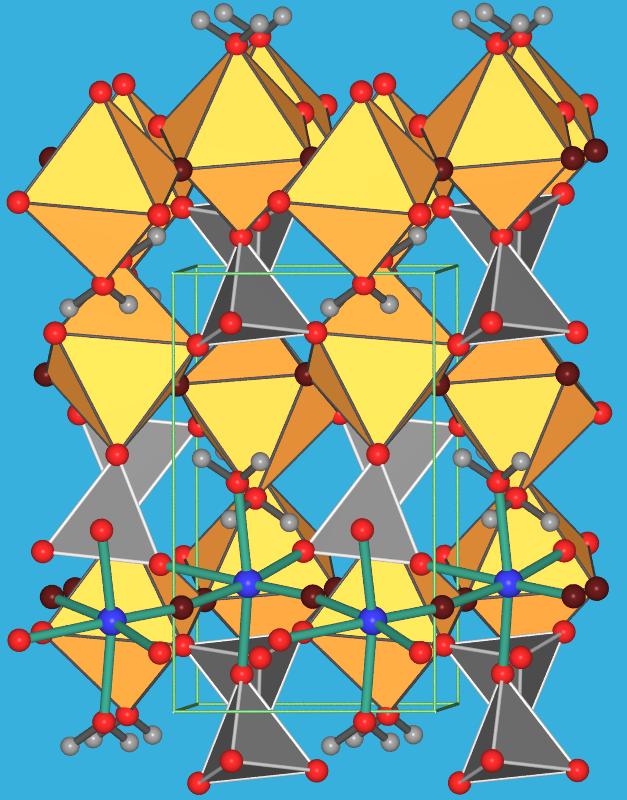 |
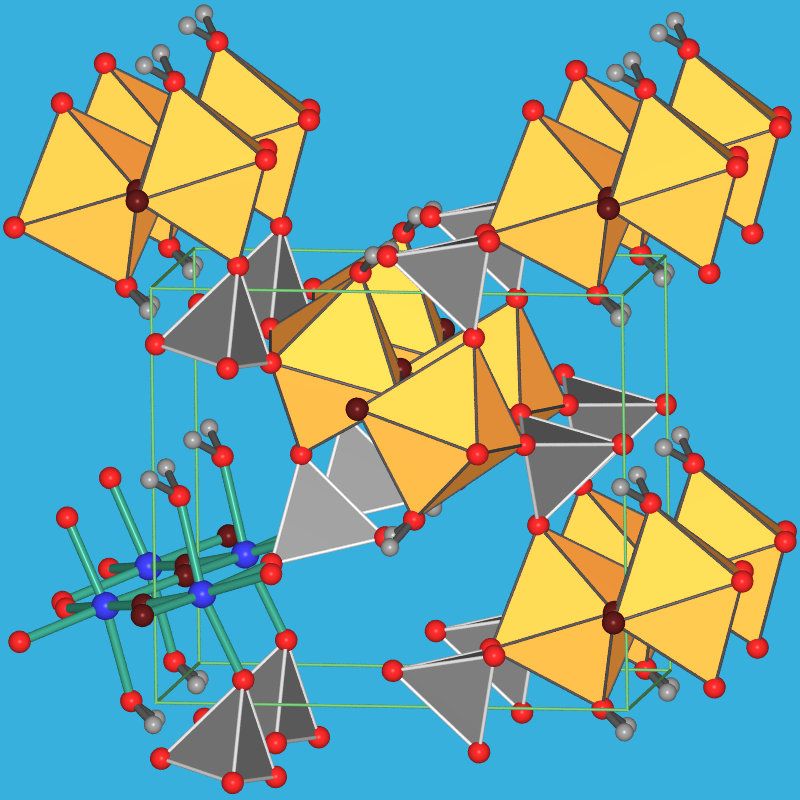 |
| 9.4.3. Struktur des
Salzes TiOSO4*H2O in zwei verschiedenen
Ansichten der Elementarzelle (rot/dunkelrot: O; blau: Ti; graue Tetraeder: Sulfat;
gelbe Oktaeder: [TiO2/2OS3(H2O)];
‣VRML |
Zum Nachweis von Titan wird das gelbe Peroxidotitanat [Ti(O2)(H2O)5]2+
genutzt, in dem der Peroxido-Ligand 'side-on' an Titan(IV) koordiniert ist:
[Ti(OH)2(H2O)4]2+ + H2O2
⟶ [Ti(O2)(H2O)5]2+ + H2O
Achtung: dieser Nachweis wird durch F- gestört, das das sehr stabile
Hexafluoridotitanat(IV) [TiF6]2- bildet.
- Ti+III liegt in wässriger Lösung und in Salzen als Hexaqua-Ion
[Ti(H2O)6]3+ vor.
Es kann durch Reduktion von Ti(IV) mit Zink erhalten werden (s. Video unten):
[Ti(OH)2(H2O)4]2+ + 2 H3O+ +
e- ⟶ [Ti(H2O)6]3+ + 2 H2O
TiCl4 + H (aus Zn + HCl) ⟶ TiCl3 + HCl
(in Ziegler-Katalysatoren)
[TiIVCl6]2- (gelb) ⟶ [TiIII(H2O)6]3+ (violett)
Ti(III) ist ein Reduktionsmittel, das z.B. von CuII, AuIII, ClO4- usw.
unter Oxidation zu Ti(IV) reagiert. Z.B.:
Ti3+ + Cu2+ ⟶ Ti4+ + Cu+
3 Ti3+ + Au3+ ⟶ 3 Ti4+ + AuO
Wie die meisten Hexaquakomplexe dreiwertiger Kationen ist auch [Ti(H2O)6]3+ eine Kationensäure:
[Ti(H2O)6]3+ + H2O
⟶ [Ti(H2O)5(OH)]2+ + H3O+
mit einem KS von 5 10-3.
Ti(III) ist ein d1-Ion, der Hexaquakomplex ist blaßviolett (s. Versuch sowie Spektrum in Abb. 9.4.4)
| ⚗ Reduktion von Ti(IV) mit Zn
(47MB|MP4|H264) |
|
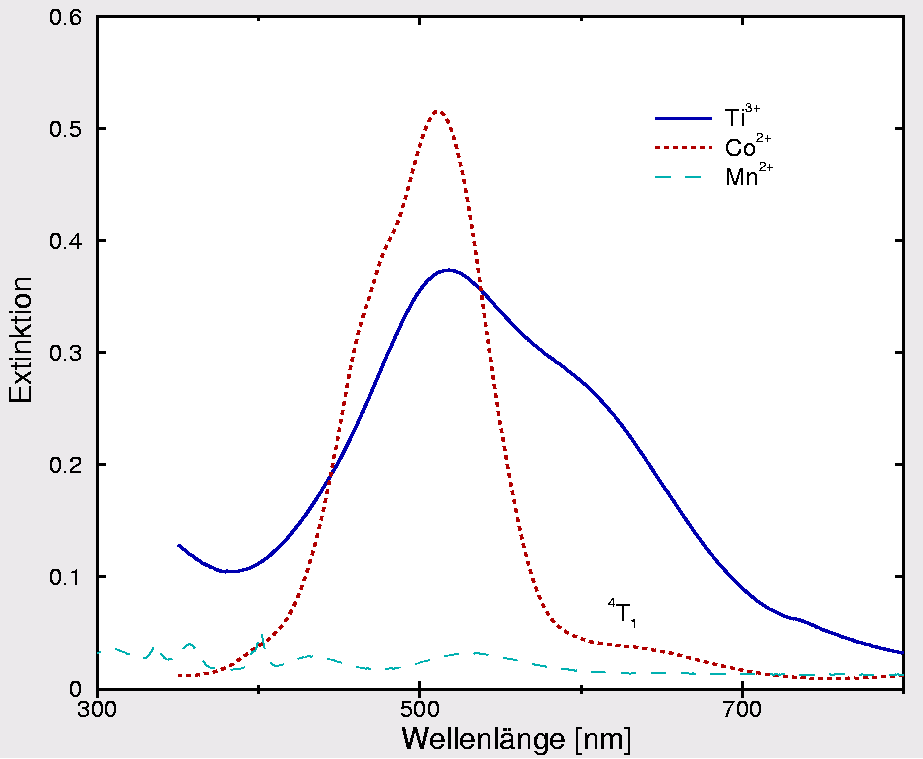
|
| Abb. 9.4.4.: UV-Spektren verschiedener Hexaquakomplexe
‣ SVG |
Die Farbigkeit resultiert aus der Ligandenfeldaufspaltung, die hier
20 300 cm-1 beträgt und damit bei 490 nm (im Blaugrünen liegt).
Sichtbar wird die Komplementärfarbe, rotviolett.
Die relativ geringe Intensität der Farbe des
Ti3+-Ions ist darauf zurückzuführen, dass es sich um
einen Laporte- und Paritäts-verbotenen d-d-Übergang (2T2g ⟶
2Eg) handelt.
Genauer betrachtet liegen zwei Banden vor, da im d1-Fall Jahn-Teller-Verzerrung eintritt.
(s. Vorlesung Methoden der Anorganischen Chemie, hier das Kapitel
zur UV/VIS-Spektroskopie).
- Titan +II ist in Wasser unbeständig,
es würde H2O zu H2 reduzieren.
Titan-Hydride
TiH4 (analog zu SiH4) ist unbekannt.
Man kennt jedoch interstitielle Hydride z.B. TiH2, bei denen Wasserstoff
in das Gitter von metallischem Titan eingelagert ist.
Titan-Halogenide und Komplexverbindungen
Die Halogenide (allgemeine Übersicht s. auch Kap. 8.4.)
werden wieder nach Oxidationsstufen getrennt besprochen:
- Von Titan(+IV) sind alle Halogenide bekannt.
In TiF4 weist Titan eine oktaedrische Sechserkoordination auf, es liegen Schichten
eckverknüpfter Oktaeder
vor. Alle übrige Tetrahalogenide sind tetraedrisch aufgebaute Moleküle.
Sie können aus den Elementen dargestellt werden:
Ti + 2 Br2 ⟶ TiBr4
Sie gehen in exothermer Reaktion rasche Hydrolysereaktionen ein:
4 TiCl4 + 4 H2O ⟶ H4TiO4 + 4 HCl
(H4TiO4 = TiO2 . x H2O)
Auch die abgeleiteten Ester sind wichtige Verbindungen, die Alkoxide Ti(OR)4
enthalten Ti4O4-Würfel als Strukturelemente.
Die Ti-Tetrahalogenide sind Lewissäuren und bilden mit Lewis-Basen stabile Komplexe:
TiCl4 + 2 HCl ⟶ H2[TiCl6] (gelb)
Das Cs- und das Ammonium-Salz, Cs2[TiCl6] und
(NH4)2[TiCl6],
sind schwerlöslich.
Der Hexafluoridokomplex ist extrem stabil:
TiO2(SO4) + 4 KF + 2 H2O ⟶
K2[TiIVF6] + K2SO4 + 2 KOH + H2O2
Technisch sehr wichtig sind die Halogenide TiCl4 und TiI4.
- Die Ti(III)-Halogeniden sind ebenfalls alle bekannt
und kristallisieren im BiI3-Typ, es liegt also oktaedrische
Koordination des Titan(III)-Ions vor.
Weitere Komplexe des Ti(III) sind
[TiF6]3- oder CsTi(SO4)2
. 12 H2O.
- Ti+II liegt in den Halogeniden TiCl2, TiBr2 und
TiI2 vor, die alle im CdI2-Typ kristallisieren.
Titan-Oxide
Im binären System Titan-Sauerstoff
(allgemeine Übersicht zu den Übergangs-Metalloxiden s. Kap. 8.5.)
gibt eine große Vielfalt an Verbindungen, s. Abb. 9.4.5.
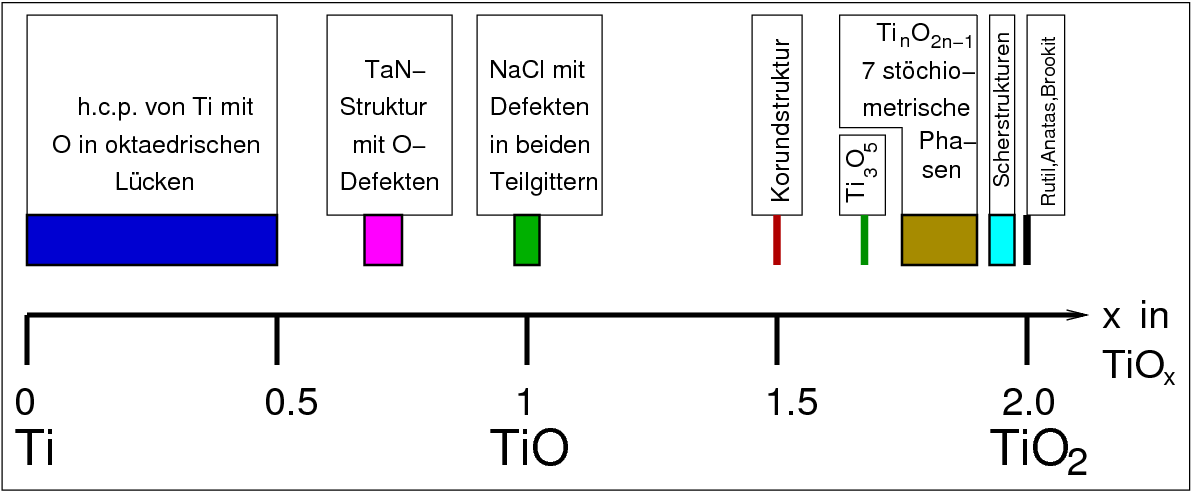 |
| Abb. 9.4.5. Verbindungen zwischen elementarem Titan und TiO2 |
Die wichtigsten, wieder nach Oxidationsstufen getrennt, sind:
- Titandioxid TiO2 ist eine stöchiometrisch scharfe Verbindung und
kommt in der Natur (verunreinigt) als Mineral Rutil, Anatas oder Brookit vor (s. Abb. 9.4.1).
Diese drei Modifikationen von Titandioxid unterscheiden sich in der
Verknüpfung der TiO6-Oktaeder:
- In der Rutil-Struktur sind
die Oktaeder über zwei gemeinsame Kanten miteinander verknüpft
- Im Brookit treten drei gemeinsame Kanten auf.
- Bei der Anatas-Modifikation haben die Oktaeder vier gemeinsame Kanten.
Im Vergleich mit SiO2 ist der saure Charakter schwächer, der basischer Charakter stärker ausgeprägt.
Titandioxid bildet eine Reihe auch technisch interessanter Titanate:
TiO2 + 2 NaOH ⟶ Na2TiO3 + H2O
TiO2 + 4 NaOH ⟶ Na4TiO4 + 2 H2O
deren Hydrolyse 'Titansäure' (TiO2 . x H2O
bzw. H4TiO4) ergibt:
Na4TiO4 + 4 H2O ⟶ H4TiO4 + 4 NaOH
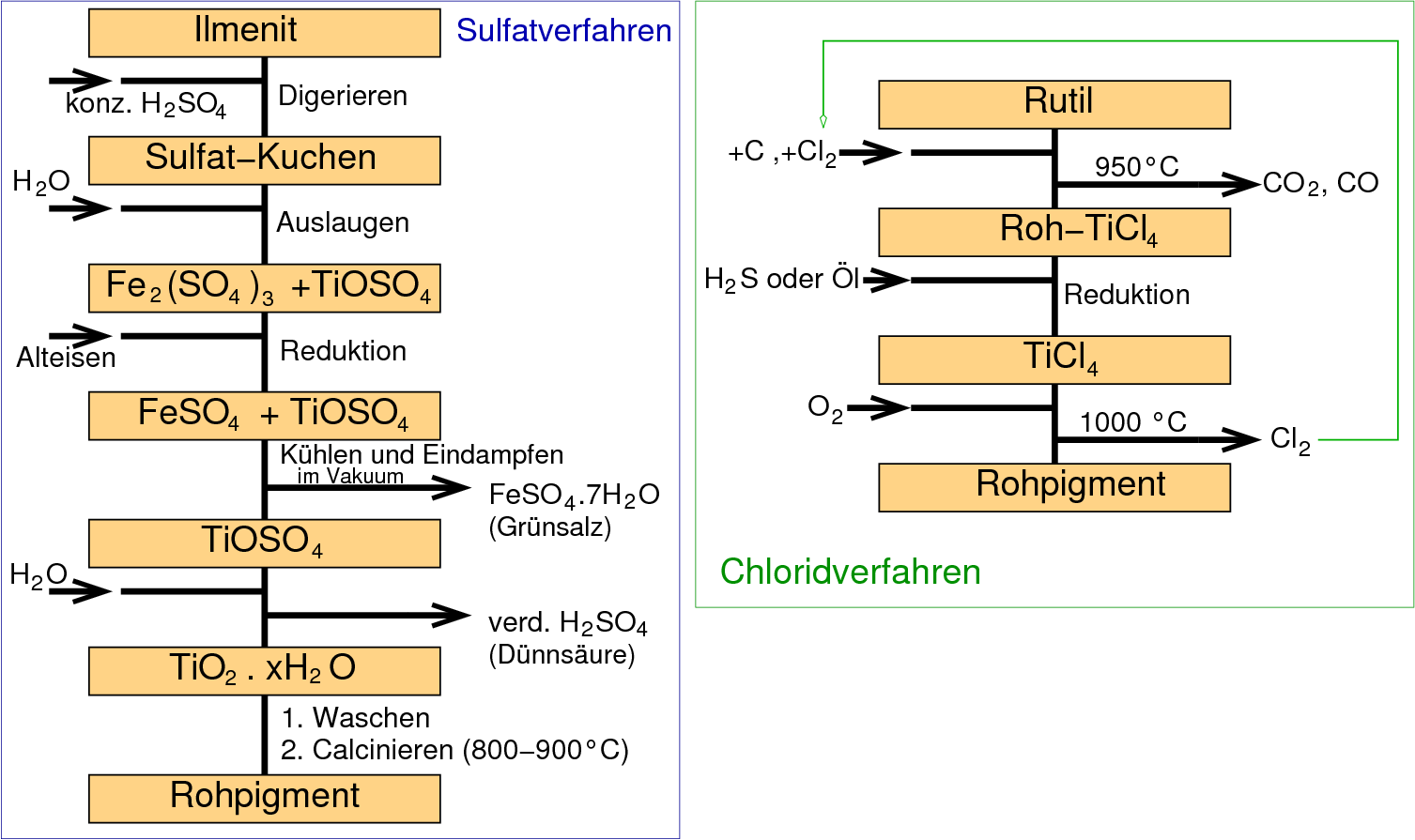
Die Herstellung von weißem, sauberen Titandioxid (Abb. 9.4.6.) erfolgt nach zwei grundsätzlich
unterschiedlichen Verfahren, wobei das erstere, das Sulfatverfahren
aus ökologischen Gründen (Anfall von sogenannter Dünnsäure) kaum noch
verwendet wird.
 |
| 9.4.6. Herstellung von TiO2-Weisspigment
‣SVG |
- Beim Sulfatverfahren
kann auch stark mit Eisen verunreinigtes TiO2 (z.B. auch der
Ilmenit, FeTiO3) eingesetzt werden. Dagegen ist der
Einsatz von reinem TiO2 nicht möglich,
da es in H2SO4 unlöslich ist.
Beim Aufschluß mit konz. H2SO4 entsteht
zunächst der sogenannte Sulfat-Kuchen, der beim Aufnehmen in Wasser vollständig löslich
ist.
Eisen, das nach dem Aufschluß ausschließlich als
Fe3+ vorliegt, wird mit Alteisen zu Fe2+ reduziert. Beim
Kühlen und Eindampfen fällt das Heptahydrat von Fe(II), FeSO4 . 7 H2O
(Grünsalz), aus
und Eisen kann damit abgetrennt werden. Die Fällung von TiO2
erfolgt beim Verdünnen mit H2O, wobei die Dünnsäure anfällt.
Durch Calcinieren erhält man reines Titandioxid.
- Bei dem moderneren Chlorid-Verfahren, für das nur reiner Rutil (d.h. nur
geringe Eisen-Anteile) verwendet werden kann, wird durch Chlorierung das
flüchtige Tetrachlorid dargestellt, das nach destillativer Aufreinigung anschließend mit O2 bei
über 1000 oC
wieder in das Oxid überführt wird:
TiCl4 + O2 ⟶ TiO2 +2 Cl2
Das elementare Chlor wird selbstverständlich wieder eingesetzt.
 |
 |
 |
 |
| Vorher: natürlicher Rutil |
Nachher: Rutil-Pigment |
Ni-Titangelb |
Titanoxid hat einen sehr hoher Brechungsindex von 2.80 (Anatas: 2.55) und daher eine hohe
Lichtstreuung. Dagegen sind die Brechungsindizes anderer Weißpigmente deutlich geringer:
- ZnS: 2.37
- Zinkit (ZnO): 2.01
- Baryt (BaSO4): 1.64
Das Streuvermögen ist zusätzlich abhängig von der Teilchengröße. Für Titandioxid
ergibt sich ein Maximum der Lichtstreuung bei Teilchengrössen von 180 bis 350 nm.
Die Ölzahl beträgt 17-26 g/100g Pigment, das Pigment ist
also in organischer Phase gut dispergierbar. Titandioxid ist ungiftig und auch als
Lebensmittelzusatzstoff zugelassen (E-Nummer 171).
Es hat eine hohe Deckkraft und gute chemische Beständigkeit.
Titandioxid wird im großen Maßstab als Weißpigment eingesetzt, z.B. als Wandfarbe,
als Lebensmittelzusatzstoff (Salami-Pelle),
in Lacken, Anstrichstoffen, Kunststoffen, Druckfarben, Fasern, Papieren
Baustoffen, Email, Keramik, Puder, Salben, Zahnpasta, Zigarren usw.
Nach der Tonnage ist Titandioxid nach Kohlenstoffschwarz das
zweitwichtigste Pigmente (Zahlen für West-Europa, in 1000 Jato,
1994):
- Carbon Black: 1302
- TiO2: 962 (Deutschland 2010: 400; Welt 2015: 6 200)
- Eisenoxide: 384
- PbCrO4: 18.6
- Ultramarine: 3.0
Titandioxid wird weiter als UV-Schutz-Pigment eingesetzt und seit 1967
(Anatas-Modifikation, in nanopartikulärer Form) als Fotokatalysator für
die Wasserspaltung diskutiert.
Vom TiO2 leiten sich weitere Buntpigmente ab, bei denen die
Ti-Positionen durch zwei unterschiedliche Metalle substituiert sind,
d.h. Titandioxid dient hier als Wirtsgitter. Hierzu gehören z.B.:
- (Ti/Cr/Sb)O2: Chrom-Rutil-Gelb
- (Ti/Ni/Sb)O2: Nickel-Rutil-Gelb (s. Foto Abb. 9.4.8.)
- (Ti/Mn/Sb)O2: Mangan-Rutil-Braun
- (Ti/V/Sb)O2: Vanadin-Rutil-Schwarz
Farbträger sind jeweils die Übergangsmetallionen, zum Ladungsausgleich
wird Sb5+ im Gitter eingebaut.
 |
| 9.4.8. Nickel-Titan-Gelb |
- Die Magneli-Phasen mit der allgemeinen Zusammensetzung TinO2n-1
z.B: n=3: Ti3O5
können als blauschwarze Buntpigmente eingesetzt werden. Diese Oxide sind elektrisch leitende Substanzen.
Solche und die unten genannten
reduzierten Phasen können auf verschiedenen Wegen erhalten werden:
- durch Erhitzen von Titandioxid auf 1500oC:
TiO2 ⟶ TiO + 1/2 O2
- durch Reduktion mit metallischem Titan ebenfalls bei 1500oC:
TiO2 + Ti ⟶ TiO (gelb)
- durch Reduktion mit Wasserstoff:
2 TiO2 + H2 ⟶ TiIII2O3 + H2O
S. auch Kapitel 4. der Vorlesung Strukturchemie der Oxide.
- TiIII2O3 ist amethyst-farben und hat Korund-Struktur.
- TiO hat NaCl-Struktur, allerdings enthalten beide Teilgitter Fehlstellen.
- TaN-Struktur
- Die Ti-Suboxide, Verbindungen die im Zustandsdiagramm zwischen Ti und Ti2O liegen,
zeigen eine hexagonal dichteste Kugelpackung mit besetzten Oktaederlücken.
Neben den reinen Oxiden sind verschiedene Oxidotitanate wichtige Materialien der Elektrotechnik.
Am bekanntesten sind die Oxidotitanate der Erdalkalimetalle, die sog.
Perowskite AIITiO3 mit einer sehr
einfachen kubischen Struktur. Diese ist
jedoch meist (tetragonal oder rhomboedrisch) verzerrt, woraus dann erst die piezoelektrischen
Eigenschaften dieser Materialien resultieren. Praktisch besonders wichtig sind dabei auch
die entsprechenden Pb(II)-Salze sowie die Mischkristalle mit Ti und Zr (Pb(Ti/Zr)O3 =
Bleizirkonattitanat = PZT).
Titan in Hartstoffen
TiN, TiC und TiB sind interstitielle feste Lösungen mit
variabler Stöchiometrie und technisch sehr wichtige Hartstoffe.
Metallorganische Verbindungen
Wichtige metallorganische Verbindungen von Titan sind:
- +IV: Titanalkyle TiR4 sind nur mit sehr sperrigen Gruppen stabiler.
Cp2TiX2 kann für die Herstellung von Sulfanen genutzt werden.
- +III: Cp2TiX ist dimer, mit 2 Halogen-Brücken.
- +II: 'Cp2Ti' kann man aus Cp2TiX2 mit Natrium
versuchen zu gewinnen. Dabei entsteht allerdings der lustige Hydrido-Komplex 'Titanocen'
mit der in Abb. 9.4.9 gezeigten Struktur.
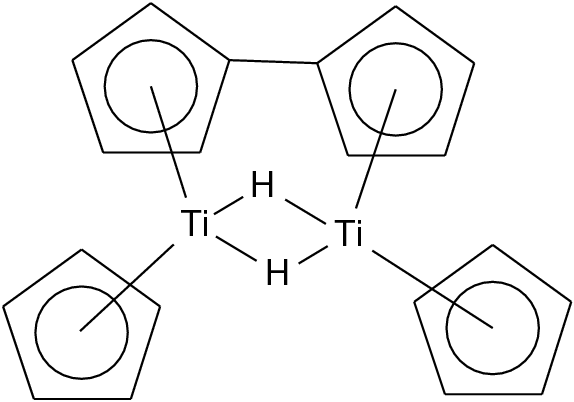 |
| 9.4.9. 'Titanocen' |
Zirkonium und Hafnium
Aufgrund der Lanthanoidenkontraktion haben die vierwertigen Kationen von Zirkonium
und Hafnium den gleicher Radius.
Die technische Darstellung von Hafnium-freiem Zirkonium ist in großen Mengen daher
schwierig. Heute werden die Ionen über Extraktionsverfahren mit Ionenaustauschern
voneinander getrennt, früher wurden fraktionierte Kristallisationen der
Hexafluoridometallate K2[MF6] durchgeführt.
Zirkonium hat einen niedrigen Einfangquerschnitt für Neutronen und ist daher in der
Kerntechnik interessant.
In der Natur kommt Zirkonium vor allem im Zirkon, ZrSiO4, vor (Abb. 9.4.10).
 |
| 9.4.10. Zirkon |
Das Element läßt sich nach dem van-Arkel-Verfahren gewinnen und reinigen.
Verwendung findet Zirkonium in Legierungen. Zirkalloy mit Zr-Gehalten > 90 % wird
in der Kerntechnik verwendet. Es dient als Getter in Glühlampen zur Beseitigung von
O2.
Das Dioxid heisst 'Zirkonia' und wird als Weiß-Pigment für Porzellan oder in keramischer
Form als Tiegel (s. Abb. 9.4.11. links) eingesetzt.
Wird ZrO2 auf 1000oC erhitzt, dann strahlt es ein
helles weiße Licht aus (Nernst-Lampe).
 |
 |
| Zirkonia-Keramik, z.B. für Tiegel |
kubisches Zirkonia (CZ), Diamant-'Imitat' (synthetischer Edelstein) |
| 9.4.11. Fotos von 'Zirkonia'. |
Mit CaO oder Y2O3 kann die kubische Form von ZrO2 (CaF2-Struktur)
stabilisiert werden,
die bei Normalbedingungen nur metastabil ist. Stabil ist die
sog. Baddeleyit-Struktur. Abbildung 9.4.12. zeigt die enge Verwandtschaft der beiden polymorphen Formen
von ZrO2.
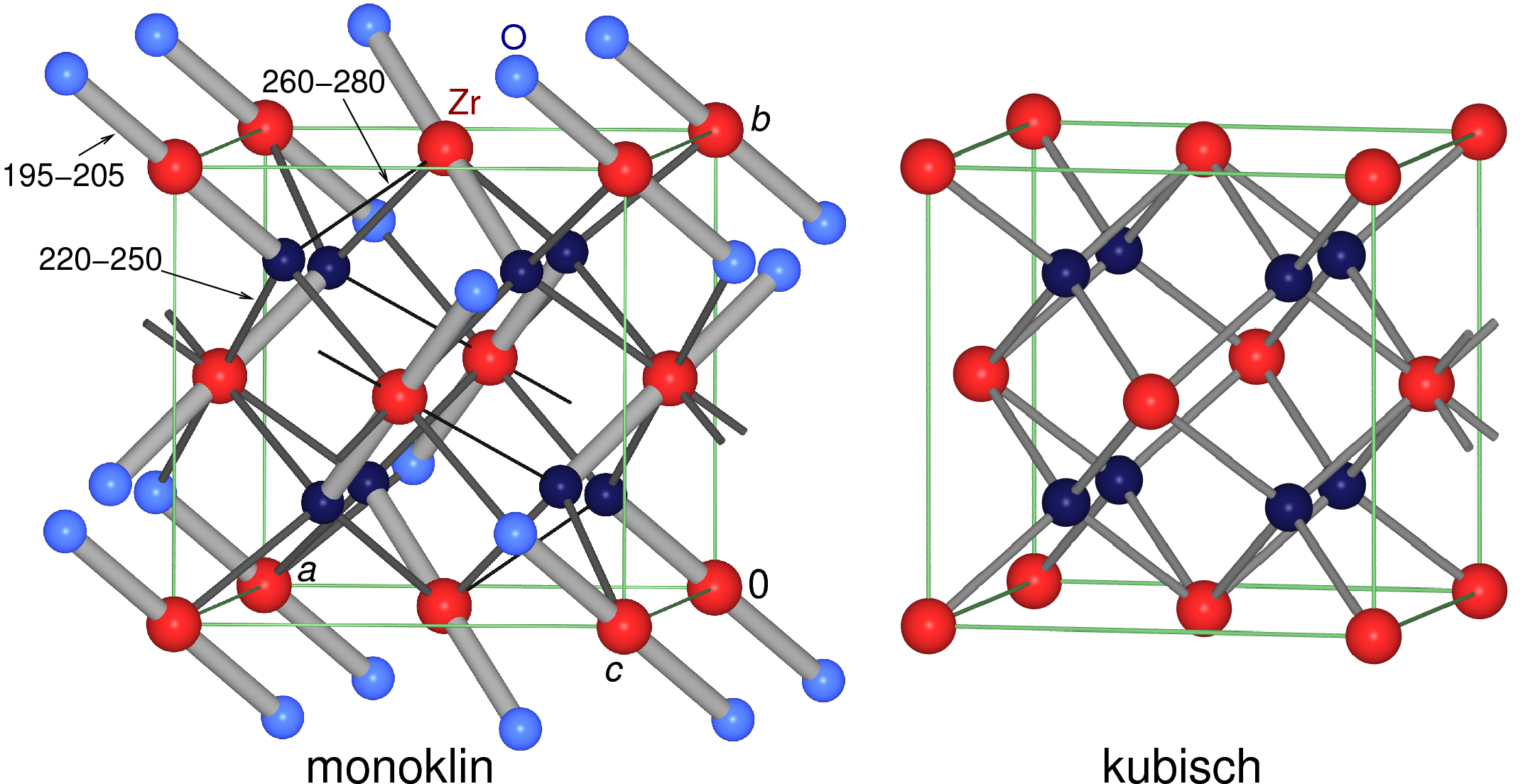 |
| 9.4.12. Strukturen der beiden Formen von ZrO2 |
Einkristalle von 'kubischem Zirkonia' (CZ) können nach dem sog. 'Skull-Melting'-Verfahren hergestellt
werden und werden als 'Diamant-Imitat' im Schmuck-Bereich vielfachst verwendet
(CZ=cubic zirconia, s. Abb. 9.4.11. rechts). Diese Anwendung basiert auf dem hohen
Brechungsindex, der grossen Härte und dem hohen Schmelzpunkt von ZrO2. Nur
die Dichte weicht sehr deutlich von der von Diamant ab. Ausser dem Preisvorteil
hat ZrO2 als Diamantimitat aber den Vorteil, dass er nicht verbrennen kann
und dass man durch Substitution der Kationenplätze heute praktisch alle
Farben gezielt erzeugen kann.
Auch bei den auf Zirkon (Zr-Silicat: ZrSiO4) basierenden Hochtemperaturpigmenten
(z.B. für Keramik) lassen sich die Farben durch unterschiedliche Subsitutionen erreichen (s. Ab.. 9.4.13.).
 |
 |
| Zirkon-Blau: VIV auf Si-Plätzen |
Zirkon-Gelb: PrIV auf Zr-Plätzen |
| 9.4.13. Zirkon-Silicat-Pigmente |
ZrO2 und HfO2 sind basische Oxide, die ausgehend vom Oxidchlorid
erhalten werden können:
ZrOCl + 2 NH3 + H2O ⟶ ZrO2 2 NH4Cl
In NaOH-Schmelzen lassen sich Zirkonate wie Na2ZrO3
und Na4ZrO4 herhalten, die in Wasser hydrolysieren.
Zr-Phosphat (Zr(HPO4)2 ?) als anorganischer
Ionenaustauscher.
andere Verbindungen mit Ionenaustauschereigenschaften:
Zirkoniumoxid-hydrat, Titanphosphat
Andere schwerlösliche Verbindungen von Zr sind
Zr(C2O4)2 und
Zr(CO3)2:
ZrOCl2 + 2 (NH4)2CO3 ⟶ Zr(CO3)2 + 2 NH4Cl + 2 NH3 + H2O
Zr(CO3)2 + (NH4)2CO3 ⟶ (NH4)2[Zr(CO3)3]
Zr bildet einen Farblack mit Alizarin (ähnlich wie Al).
Mit Fluorid bildet Zr(IV) den sehr stabilen Komplex
[ZrF7]3- mit der seltenen Koordinationszahl 7, mit
Chlorid ist dagegen der oktaedrische Komplex [ZrCl6]2-
stabil.
Das Element Hafnium wurde von Georg von Hevesy (in Freiburg von 1931-1933)
mit Hilfe der Röntgenfluoreszenz entdeckt!























