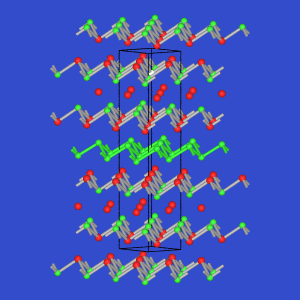
In den folgenden Tabellen ist die Strukturchemie in VRML-Abbildungen
zusammengestellt. Ausgewähle Strukturen sind unten auch als statische Bilder dargestellt.
In den VRML-Bildern ist Se und Te in rot gekennzeichnet,
z.T. sind die Strukturen mit [M(Se/Te)x]-Polyedern dargestellt.
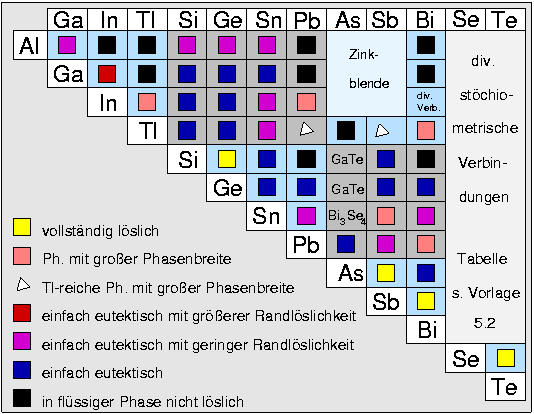
| E(III)-Se/Te | Selen-Verbindungen | Tellur-Verbindungen |
| Verbindung | Strukturtyp | Verbindung | Strukturtyp |
| Al |
Al2Se3 |
Ga2S3 (Kugeln, Polyeder) |
|
|
| Al2Se3 |
Defekt-Wurtzit |
Al2Te3 |
Defekt-Wurtzit |
| Ga |
Ga2Se3 |
Ga2S3 (Kugeln, Polyeder) |
|
|
| Ga2Se3 |
Defekt-Zinkblende (Polyeder, Kugeln) |
Ga2Te3 |
Defekt-Zinkblende (Polyeder, Kugeln) |
| GaSe |
GaSe(rhomb.: ABC) |
GaTe |
GaTe (monokl.) |
| GaSe |
GaS (hex.: AB) |
GaTe |
GaS (hex.: AB) |
| |
|
Ga2Te5 |
Ga2Te5 |
| In |
In2Se3 |
Bi2Te3 (Schicht:
Kugeln
Bi-Pol.
Te1-Pol.; Zelle:
Kugeln;
Bi-Pol.)
|
In2Te3 (HP) |
Bi2Te3 (Schicht:
Kugeln
Bi-Pol.
Te1-Pol.; Zelle:
Kugeln;
Bi-Pol.)
|
| In2Se3 (HT) |
In2Se3 |
In2Te3 |
Defekt-Zinkblende
(Polyeder, Kugeln) |
| InSe |
GaSe (rhomb.: ABC) |
InTe |
TlSe (Kugeln), (Polyeder) |
| InSe |
GaS (hex.: AB) |
InTe (HP) |
NaCl |
| InSe |
InSe (HP) (monokl.) |
|
|
| |
|
In2Te5 |
In2Te5 |
| In4Se3 |
In4Se3 |
In4Te3 |
Bi3Se4 Schicht-Polyeder |
| In6Se7 |
In6S7 kompl. |
|
|
| Tl |
Tl2Se3 |
Defekt-Wurtzit |
Tl2Te3 |
Tl2Te3 (2 Tl+ + Te32-) |
| TlSe |
TlSe (Kugeln,
Polyeder) |
TlTe |
TlTe (4 Tl+ + Te0 + [Te2-Te-2]4- |
| Tl5Se3 |
Tl5Se3 |
Tl5Te3 |
Cr5B3 |
Die wichtigsten Verbindungen der Elemente der 3. Hauptgruppe mit
Selen und Tellur sind die mit den Zusammensetzungen AB und
A2B3. Daneben gibt es einige Verbindungen mit
A2B5-Stöchiometrie und Tl- bzw. In-reiche Phasen
mit Clusterstrukturen.
- AB:
Die Verbindungen folgen alle der 8-N-Regel streng, obwohl die Details
der Strukturen sehr verschieden sind. Bis auf TlSe
enthalten die Strukturen stets eine E(III)-E(III)-Bindung, so daß
das Erdmetall hier in tetraedrischer E(III)E(III)E(VI)3
Koordination vorliegt. Selen und Tellur sind in diesen Verbindungen dreibindig.
GaSe
und InSe enthalten gleichartige Schichten in unterschiedlicher
Stapelfolge. In GaTe resultiert
bei gleichen Bauelementen eine Schicht mit vollkommen anderem Aufbau.
Im Unterschied zu den genannten Strukturen ist
TlSe als Tl+ +
[TlSe2]- zu formulieren. Das Anion ist dabei
isoelektronisch zum SiS2 und liegt entsprechend in Form von über
gegenüberliegende Kanten verknüpften
TlSe4-Tetraederketten
vor.
- Die Stöchiometrie A2B3
entspricht den zu erwartenden Ionenladungen mit E(III) der Ladung 3+ und E(VI)
mit der Ladung 2-. Der
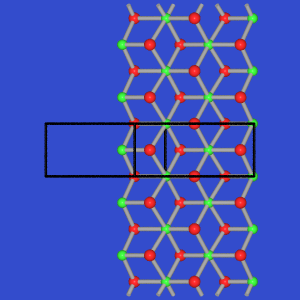
Ga2S3-Typ
tritt für Al2Se3 und Ga2Se3 auf und
besteht aus einem Raumnetz aus
[GaSe4]-Tetraedern,
Se ist 3-bindig. Die Struktur kann als geordnete Defekt-Variante der
Zinkblende betrachtet werden.
Tl2Te3
bildet eine komplizierte Schichtstruktur, in der
Tl in psi-trigonaler Koordination vorliegt.
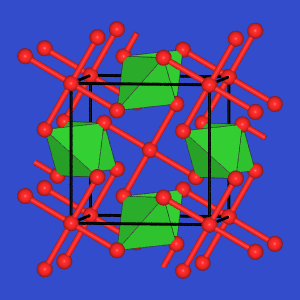
- A2Te5:
Te-reiche Phasen von Ga und In sind bei Ausbildung von Te-Te-Bindungen realisierbar.
Ga2Te5
enthält Tetraederketten GaTe2 wie in SiS2.
Die Te-Atome der Ketten sind über Te in quadratisch planarer
Koordination (Te2-) verknüpft. Die Struktur l"a"st sich also durch
die formal ionische Zerlegung in Te2- und
zwei [Ga-Te+]+-Baugruppen erkl"aren.
In2Te5 enthält Ketten aus
InTe4/3-Tetraedern, die über
Te3-Kettenstücken verknüpft sind (ionische Zerlegung:
In-, Te3/3+, Te0 und Te1/20)
 |
 |
| Ga2Te5 |
In2Te5 |
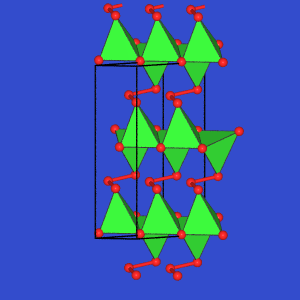
- Die E(III)-reichen Verbindungen
In4Se3 und
Tl5Se3
lassen sich nicht mehr nach einfachen Z"ahlregeln erkl"aren. In In4Se3
kommt es zur Oktett"uberschreitung, die Tl-Verbindung enth"alt Cluster aus Tl-Oktaedern,
über deren Flächen Se-Atome lokalisiert sind (gr"une Polyeder).
 |
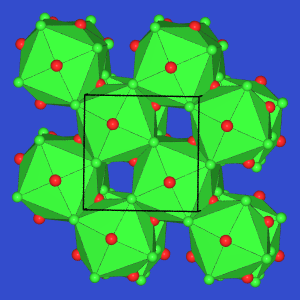 |
| In4Se3 |
Tl5Se3 |
E(IV)-Se/Te
| E(IV)-Se/Te | Selen-Verbindungen | Tellur-Verbindungen |
| Verbindung | Strukturtyp | Verbindung | Strukturtyp |
| Si |
SiSe2 |
SiS2 |
SiTe2 |
CdI2 |
| |
|
Si2Te3 |
statistische Pos. |
| Ge |
GeSe2 |
GeSe2 | e
|
|
| GeSe |
GeS |
GeTe |
GeS |
| |
|
GeTe |
NaCl |
| Sn |
SnSe2 |
CdI2 |
|
|
| SnSe |
GeS |
SnTe |
GeS |
| SnSe (HT) |
CrB |
|
|
| Pb |
PbSe |
NaCl |
PbTe |
NaCl |
| PbSe (HP) |
GeS |
PbTe (HP) |
GeS |
Auch bei den Seleniden und Telluriden der Elemente der 4. Hauptgruppe
gibt es zahlreiche Verbindungen mit sehr unterschiedlichen Zusammensetzungen
und Strukturen:
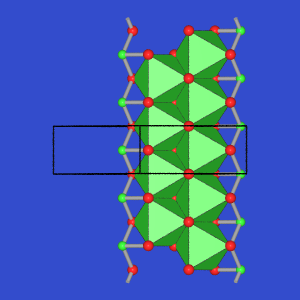
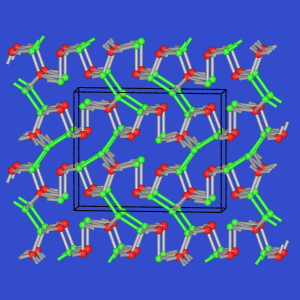
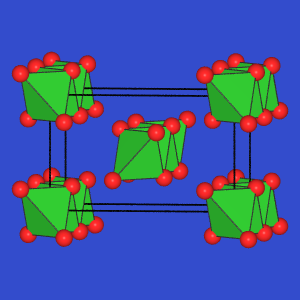
- AB2: Die Si-Verbindungen dieser Zusammensetzung
kristallisieren im SiS2-Typ, bestehen damit aus
kantenverknüpften SiS4-Tetraedern.
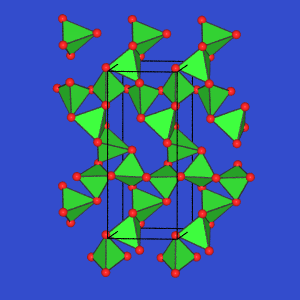
In GeSe2 finden sich dagegen Tetraederdoppel,
die über Ecken weiter verknüpft
sind.
 |
 |
| SiS2-Typ |
GeSe2 |
- Verbindungen der einfachen AB-Zusammensetzung
(IV-VI-Verbindungen) sind isoster zu den Elementen der 5. Hauptgruppe und
zeigen entsprechende Strukturmerkmale, d.h. sie sind als Überstrukturen der
grauen As- (GeTe)
bzw. der Pschwarz-Struktur (GeSe, SnSe) anzusehen.
Bei den schwereren Homologen wie z.B. SnTe, PbSe und PbTe kommt es zur
Oktettaufweitung und es liegt der NaCl-Typ vor (Te und Pb jeweils
oktaedrisch vom anderen Verbindungspartner koordiniert).
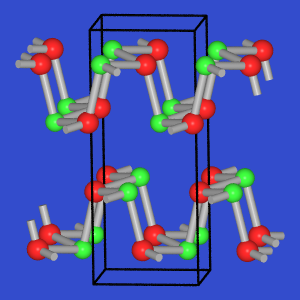 |
| GeSe |
E(V)-Se/Te
Die Se- und Te-Verbindungen der Pentele (Elemente der 5. Hauptgruppe)
bilden den Übergang zu aus der Molekülchemie bekannten Baumustern.
Molekulare Einheiten finden sich z.B. in
As4Se4
und As4Se3.
Die Struktur von As2S3
As2Te3
(in Polyederdarstellung)
enthalten Doppelketten aus Oktaedern,
außer über trig. verknüpft.
Sb2Se3
Die Schichtstruktur von Sb2Te2
besteht gemäß
4 Schichten wie As = (SbTe)4)4+ und 1* reine
Sb-Schicht + 2 Te2-.