Strukturtypen-Datenbank: Sonstige
Alaun-Struktur
(AIMIII(SO4)2(H2O)12)
Beschreibung ( VRML )
Alaune mit der allgemeinen Formel
AIMIII(SO4)2(H2O)12
sind wasserhaltige Doppelsalze aus
Alkalimetall- oder Ammoniumsulfat AI2[SO4]
und Metall-Sulfaten MIII2[SO4]3
der dreiwertigen Kationen M wie z.B. von Al, Ga, In, Sc, Ti, V, Cr, Mn, Fe, Co, Rh oder Ir.
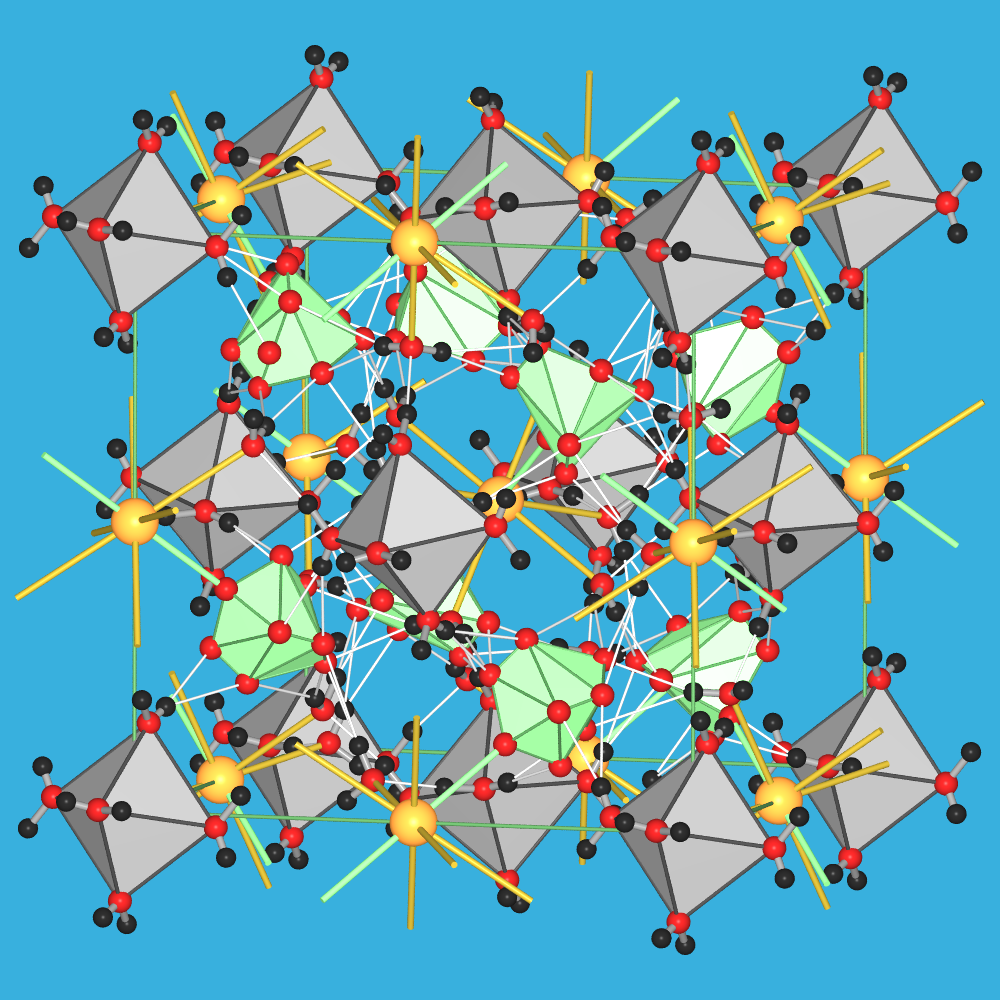
Alaune kristallisieren in Form grosser Würfel und Oktaeder. Die
Struktur ist kubisch, die Raumgruppe ist Pa3̅.
Die MIII-Kationen
sind oktaedrisch von Wassermolekülen koordiniert (graue Oktaeder).
Die [Al(H2O)6]3+-Komplexkationen liegen isoliert
voneinander vor und besetzen die Ecken und die Flächenmitten
der kubischen Elementarzelle. Es liegt jedoch keine F-Zentrierung mehr vor, da die
Oktaeder leicht gegen die Elementarzellkanten verkippt sind. Die Sulfat-Tetraeder,
die leider fehlgeordnet sind und daher in der Abbildung nicht als Tetraeder zu
erkennen sind, sondern nur als grüne Polyeder-Trümmer aus zwei einander durchdringenden
Tetraedern, befinden sich in allen Tetraederlücken der kubisch dichtesten Oktaederpackung.
Damit ist das Verhältnis von SO42--Tetraedern
zu [Al(H2O)6]3+-Komplex-Kationen von 2:1 erklärt
(vgl. Fluorit-Typ).
Die Alkalimetall-Kationen AI befinden sich in den Oktaederlücken
der Oktaederpackung, d.h. das Verhältnis von A:M ist wie im
NaCl-Typ 1:1.
Die Hälfte der 12 Wassermoleküle ist an die MIII-Kationen gebunden,
die anderen 6 Wassermoleküle bilden mit den gebundenen H2O-Molekülen ein ausgedehntes
Wasserstoffbrücken-Bindungssystem (dünne weisse Stäbe). Die AI-Kationen
sind von zwei Oxid-Ionen der Sulfat-Tetraeder und von 6 der 'freien' Wassermoleküle
umgeben. Diese Koordinationssphäre ist mit dünnen gelben und grünen Stäben
um die AI-Kationen eingetragen.
Vorkommen
Die Alaun-Struktur gibt es mit den Kationen:
A+ = Na+, K+, Rb+, Cs+,
NH4+, Tl+ (Li+ ist dagegen zu klein!)
M3+ = Al3+, Ga3+, In3+,
Sc3+, Ti3+, V3+, Cr3+, Mn3+,
Fe3+, Co3+, Rh3+, Ir3+
Verwendung, Eigenschaften
Zur Chemie und Verwendung der Alaune s. Kap. 4.5.
der Vorlesung Chemie der Metalle.
