Vorlesung Chemie der Metalle
1. Einleitung, Allgemeines
1.4. Strukturen der Metalle
Fast alle Metalle kristallisieren in einem der drei folgenden Strukturtypen:
- kubisch innenzentrierte Packung = body-centered cubic = b.c.c.
- hexagonal dichteste Kugelpackung = hexagonal close packed = h.c.p.
- kubisch dichteste Kugelpackung = kubisch flächenzentrierte Packung =
face centered cubic = f.c.c.
Die drei Strukturtypen bauen auf zwei Anordnungen von Kugeln in der Ebene auf:
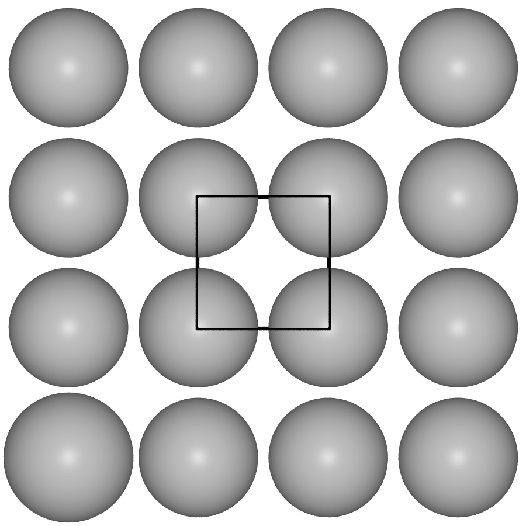
- I. Einer quadratischen Anordnung von Kugeln in der Ebene (44-Netze in der Schläfli-Nomenklatur)
im Fall der b.c.c.-Struktur.
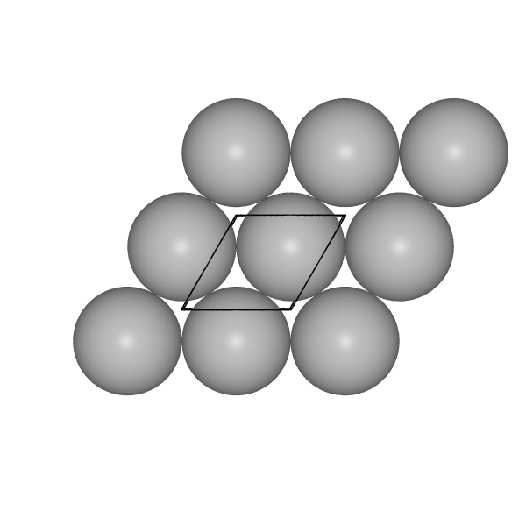
- II. Einer hexagonal dichtesten Packung von Kugeln in der Ebene
(36-Netze)
im Fall der h.c.p.- und der f.c.c-Struktur.
Zu den drei Strukturen im Detail, grundlegende Abbildungen s. Tab. 1.4.1 unten):
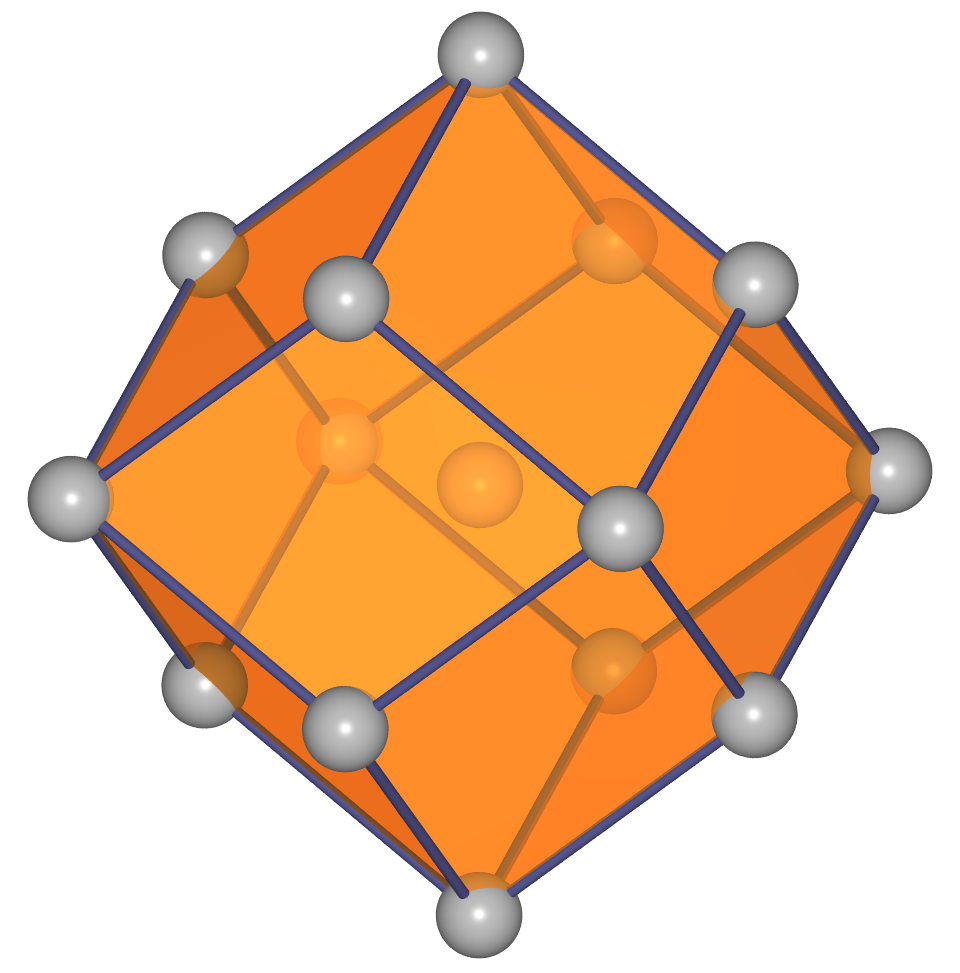
- b.c.c. oder kubisch innenzentriert oder W-Typ:
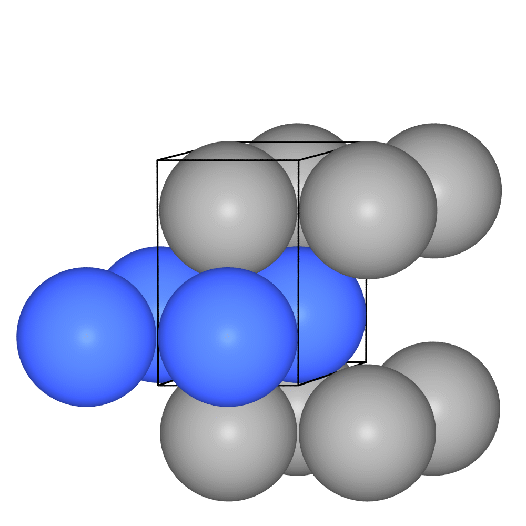
Basis der kubisch innenzentrierten Metallpackung sind quadratische Schichten,
die in der Folge A-B-A gestapelt sind.
Die Kugeln berühren sich innerhalb der Schichten nicht, die Kontakte der Kugeln
verlaufen vielmehr auf den Würfeldiagonalen.
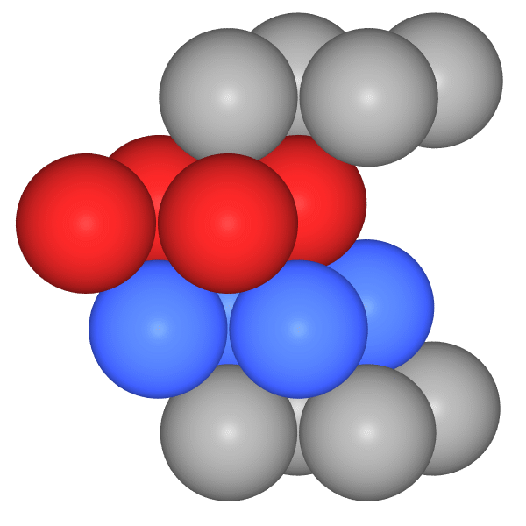
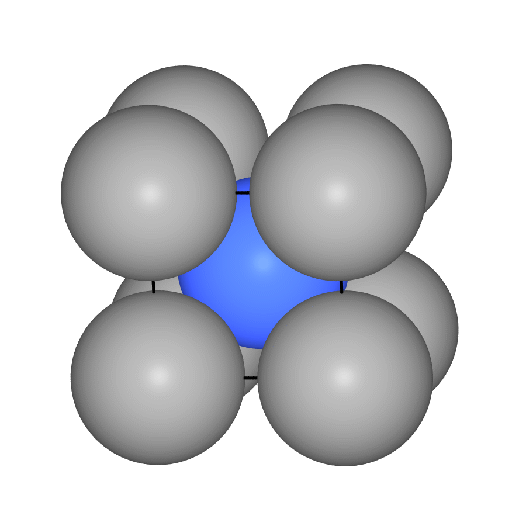
Das Koordinationspolyeder um die Atome ist ein Würfel (CN 8, Atomabstand
0.866*Gitterkonstante a) und in etwas weiterer Entfernung (Atomabstand 1*a) ein weiteres
Oktaeder, so dass insgesamt die Koordinationszahl 8+6 und als Polyeder ein Rhombendodekaeder folgt. Die Raumerfüllung
einer solchen Anordnung von Kugeln beträgt 68.02 %.
Weitere Abbildungen s. in der linken Spalte der Tabelle 1.4.1.
Die folgenden VRMLs zeigen
- einen Ausschnitt aus der Gesamtstruktur,
- ein zusammengesetztes Koordinationspolyeder
(CN: 8 (Würfel, rot) + 6 (Oktaeder, grau) in der Darstellung mit Kugeln bzw.
- in der Polyederdarstellung und
- ein VRML2 des Übergangs von der Kugel- zur Polyederdarstellung
(!! geht nicht mit allen VRML-Betrachtern!) .
- Die beiden nächsten Metallstrukturen, die hexagonal und die
kubisch dichteste Kugelpackung, sind echte dichteste Kugelpackungen
im Raum,
d.h. es handelt sich um diejenigen Anordnungen identischer Kugeln mit der
maximalen Dichte und der maximalen Raumerfüllung von 74.05 %.
Basis der beiden Strukturen (und vieler Varianten) ist die
Packung von Kugeln in einer dichten Schicht in der Ebene (36-Netze).
Diese Schichten sind im Prinzip in beliebigen Stapelfolgen denkbar.
Am wichtigsten sind aber:
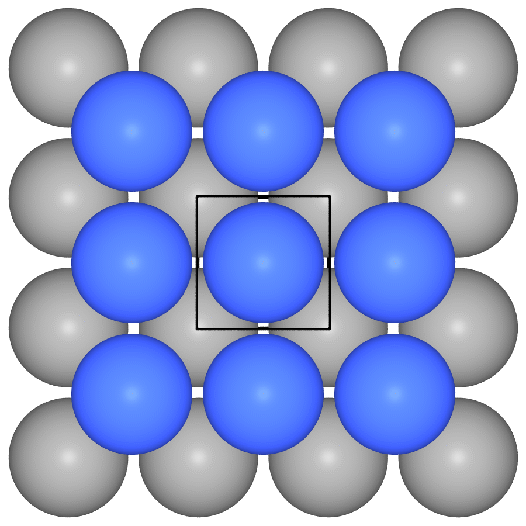
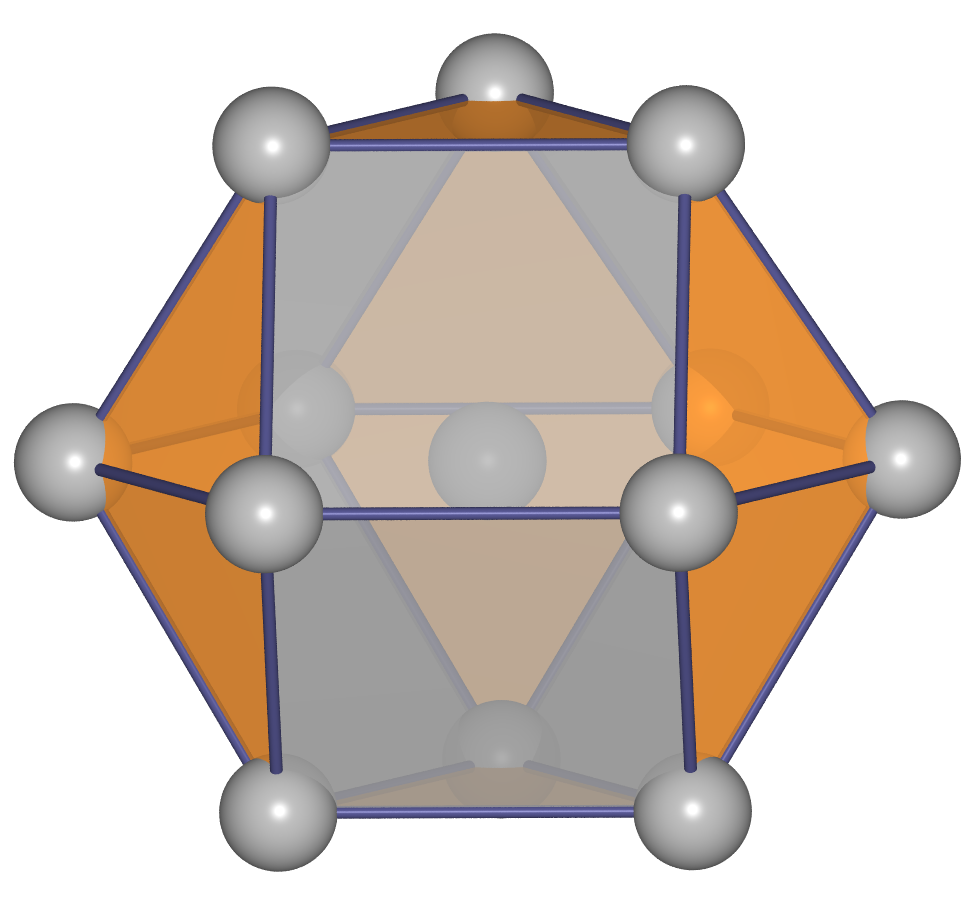
- f.c.c. oder kubisch flächenzentriert
oder kubisch dichteste Kugelpackung oder Cu-Typ:
Die Stapelfolge der Schichten ist ||:ABC:||. Die dichtesten Schichten
verlaufen senkrecht zu allen Raumdiagonalen der kubischen Elementarzelle. Als Koordinationspolyeder
ergibt sich ein Kuboktaeder (CN 12).
Statische Abbildungen siehe Tabelle 1.4.1., rechte Spalte.
Und ein paar Bilderserien in VRML:
- Aufbau der Gesamtpackung:
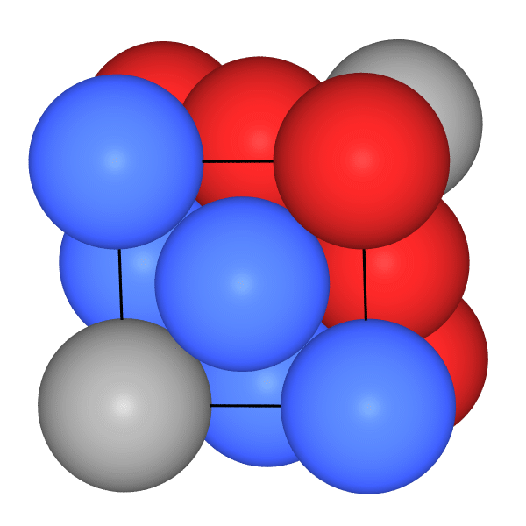
- In der ersten Abbildung eine
dichteste Kugelschicht in der Ebene (rot) und die ersten Atome der folgenden
Schicht B (gelb).
- Dann
kommt die 3. Schicht (C, in blau), die (senkrecht zur Schichtebene)
weder genau über A noch genau über B liegt.
- Die vierte Schicht (eine Kugel und
komplette Schicht)
ist wieder identisch mit der ersten (A-B-C-A-Stapelung).
- Diese Stapelfolge liegt senkrecht zu allen Raumdiagonalen der Elementarzelle
( hier zum Probieren).
- Ausschnitte aus der Gesamtstruktur:
- und das Koordinationspolyeder:
- b.c.c.- und f.c.c.-Struktur sind gar nicht so sehr verschieden, wie es auf
den ersten Blick scheint. Dazu dieses dynamische VRML-2 (!! nicht mit allen
VRML-Betrachtern darstellbar, z.B. freewrl nehmen) zeigen diesen sog. Martensit-Übergang.
Versuchsweise mal direkt eingebunden:
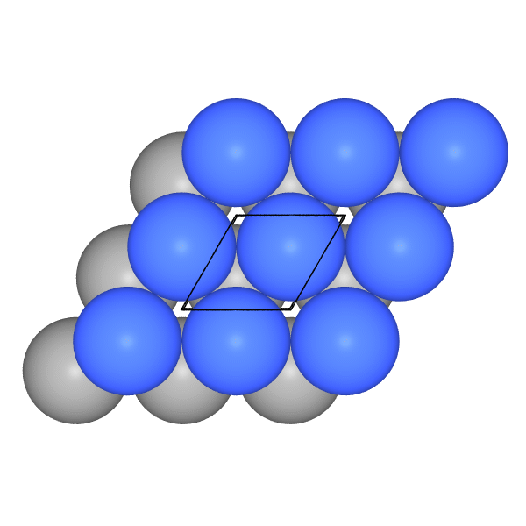
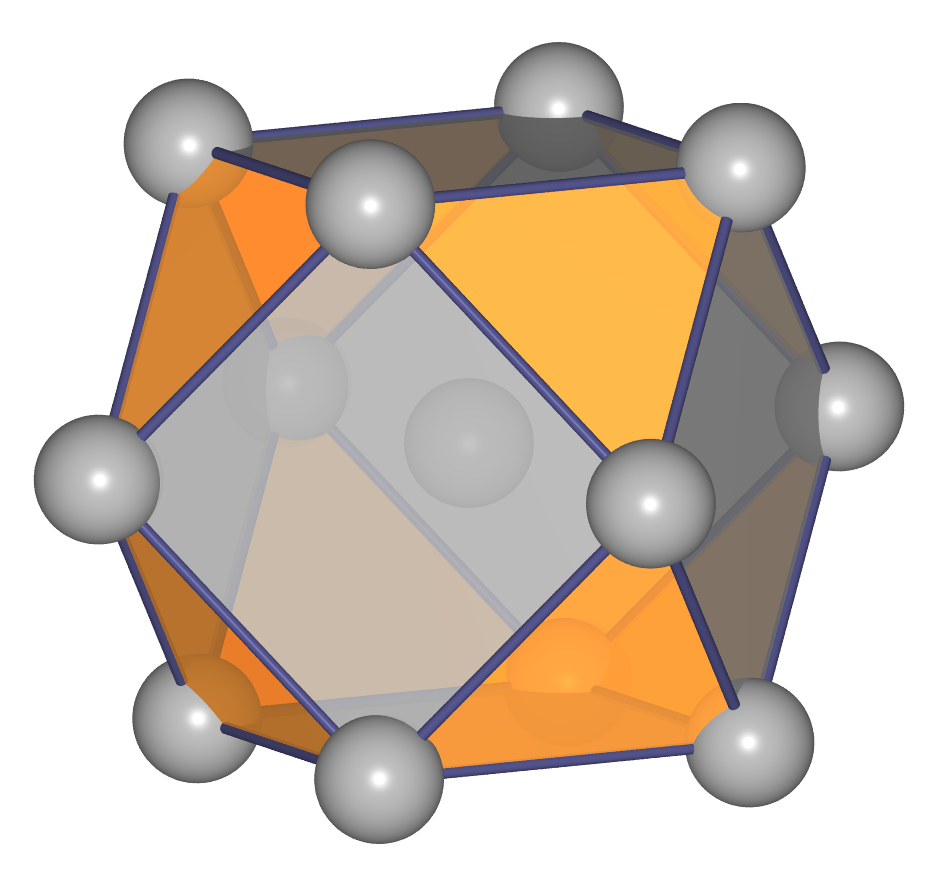
- h.c.p. oder hexagonal dichteste Kugelpackung oder Mg-Typ:
Hier sind die dichten Schichten in der Stapelfolge ||:AB:|| angeordnet, das
Koordinationspolyeder (CN 12) ist ein sog. Antikuboktaeder.
Statische Abbildungen siehe Tabelle 1.4.1., mittlere Spalte.
Auch hierzu eine Bilderserie in VRML:
Die Tabelle 1.4.1. fasst die drei Strukturtypen zusammen.
Tab. 1.4.1. Abbildungen zu den Strukturen der Metalle
↪
VL 1.2. unten
In seltenen Fällen finden sich auch andere Stapelfolgen, z.B. gibt es bei den
frühen Lanthanoiden und bei Lanthan selber auch Vertreter mit einer sogenannten doppelt-hexagonalen Stapelung (d.h.c.p.),
der Stapelfolge ||:ABAC:||.
Viele Metalle sind darüberhinaus polymorph, d.h. es gibt abhängig von Temperatur und Druck
unterschiedliche Strukturen.
Ein wichtiges Beispiel ist das Eisen mit den folgenden temperaturabhängigen
Phasenumwandlungen:
α-Fe (bcc) ⟶ 910 oC ⟶ γ-Fe (fcc)
⟶ 1390 oC ⟶ δ-Fe (bcc)
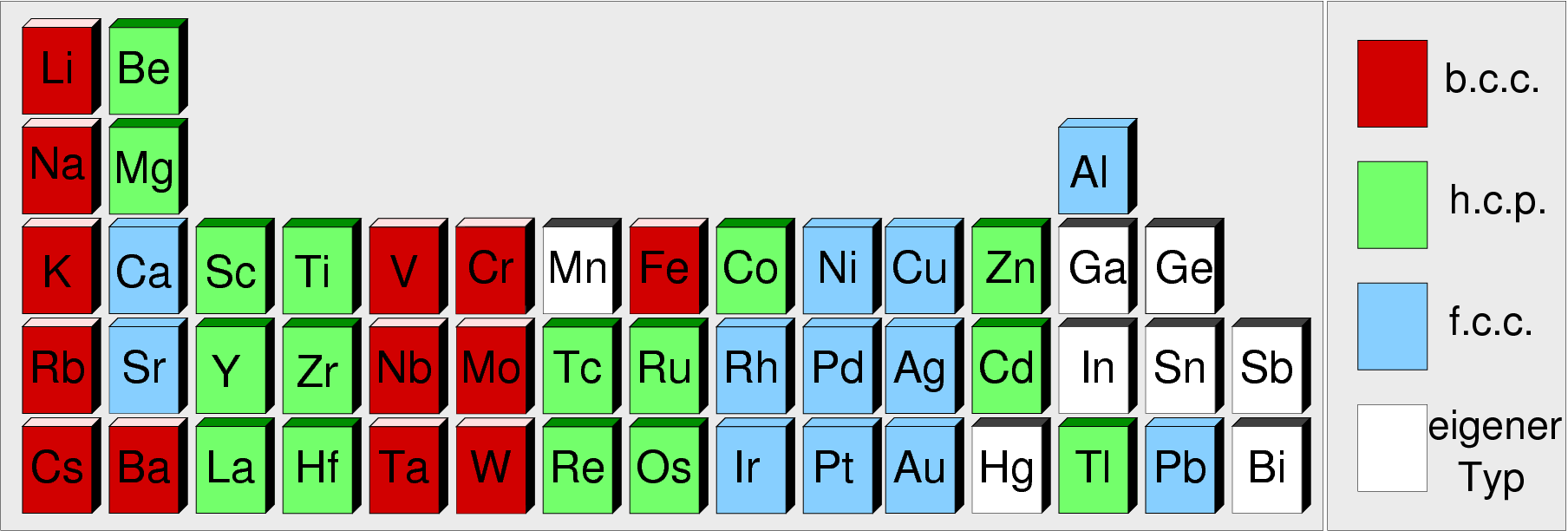
Die Verteilung der Strukturtypen im Periodensystem ist der folgenden Übersicht
Abb. 1.4.1. zu entnehmen:
Die Abfolge der Strukturtypen ist nur mit Rechnungen auf gutem theoretischen Niveau
über die elektronischen
Strukturen erklärbar (Details dazu siehe
Kap. 2.3. der Vorlesung Intermetallische Phasen).
Der Strukturtyp eines Metalls bestimmt auch entscheidend die mechanischen Eigenschaften
der Metalle: Metalle und Legierungen mit kubisch dichtester Kugelpackung (f.c.c.) haben die meisten
sog. 'Gleitsysteme', d.h. die Verscheibung der Schichten gegeneinander ist in vielen
Richtungen relativ einfach möglich. Diese Metalle sind daher duktil und damit
mechanisch einfach zu verarbeiten (z.B. Cu).
Die beiden dichtesten Kugelpackungen sind in mehrfacher Hinsicht
für die gesamte Strukturchemie wichtig, denn:
- Fast alle Metalle kristallisieren in einem der drei obengenannten Strukturtypen.
- In den meisten Legierungen (d.h. Verbindungen der Metalle untereinander!)
treten dieselben Baumuster auf, wobei es entweder zur geordneter oder
ungeordneter Substitution der Atompositionen kommt
(s. hierzu Kap. 3.2. Substitutionsmischkristalle
aus der Vorlesung Intermetallische Phasen).
- In den Strukturen der meisten Ionenkristalle bildet die größere Atomsorte
(d.h. meist die Anionen) eine analoge Teilstruktur aus. Daher ist die
Analyse der Packung in Hinblick auf die vorhandenen Lücken wichtig für
die gesamte Strukturchemie der Salze (s. z.B. Kap. 2.3).
Und hier noch ein Video zu den beiden dichtesten Kugelpackungen aus Corona-Zeiten ...
| ✍ Dichteste Kugelpackungen: Prinzip, h.c.p.- und f.c.c.-Struktur (69MB|MP4|H264) |
|
Viele weitere Informationen und auch die Strukturchemie der wenigen Metalle
mit abgeleiteten Packungen sind in den Vorlesungen
zu finden.
Im folgenden beginnt die Besprechung der Chemie der Hauptgruppenmetalle, beginnend im Periodensystem links
mit der sehr einheitlichen Gruppe der Alkalimetalle (I. Hauptgruppe, 1. Gruppe, Kap. 2).