|
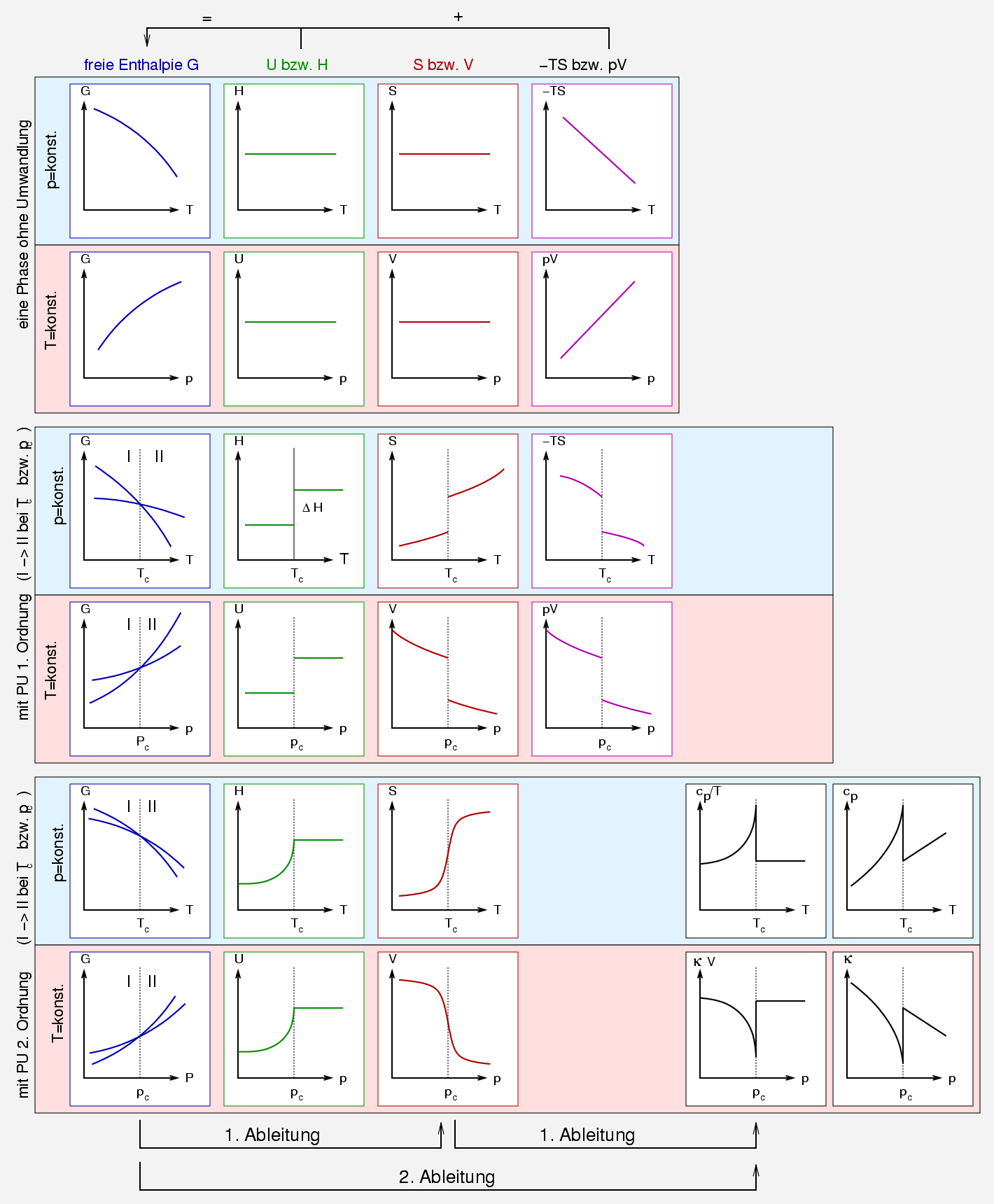
| Abb. 2.1.1. thermodynamische Klassifizierung von Phasenumwandlungen. ‣ SVG |
| cr_home | Metalle | Nichtmetalle | Strukturchemie | Methoden | Interm. Phasen | Oxide | Silicate | Strukturtypen |
| ← | Inhalt | 1. Bau + Strukturen | 2. Reaktionen + Synthesen | 3. Eigenschaften + Anwendungen | → |
Vorlagen und Präsentationen

|
| Abb. 2.1.1. thermodynamische Klassifizierung von Phasenumwandlungen. ‣ SVG |
| Grundtyp | atomare Prozesse | Geschwindigkeit | Beispiel |
|---|---|---|---|
| Phasenumwandlungen mit Änderung in der 1. Koordinationssphäre | Rekonstruktion | langsam | Diamant ⟶ Graphit |
| Dehnung (dilational) | schnell | NaCl ⟶ CsCl | |
| Phasenumwandlungen mit Änderung in der 2. Koordinationssphäre | Rekonstruktion | langsam | α-Quarz ⟶ Cristobalit |
| Verschiebung (displaziv) | schnell | α-Quarz ⟶ β-Quarz | |
| Ordnungs-Unordnungs-Übergänge | Substitution | langsam | α-LiFeO2 ⟶ β-LiFeO2 |
| Umorientierung | schnell | ferroelektr. ⟶ paraelektr. NH4H2PO4 | |
| Rotation | schnell | ||
| Phasenumwandlung mit Änderung des Bindungstyps | langsam | α-Sn ⟶ β-Sn |
| ← | Inhalt | 1. Bau + Strukturen | 2. Reaktionen + Synthesen | 3. Eigenschaften + Anwendungen | → |
| cr_home | Metalle | Nichtmetalle | Strukturchemie | Methoden | Interm. Phasen | Oxide | Silicate | Strukturtypen |